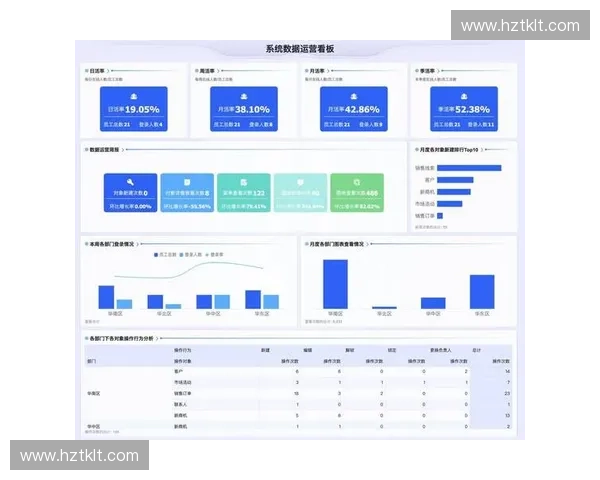
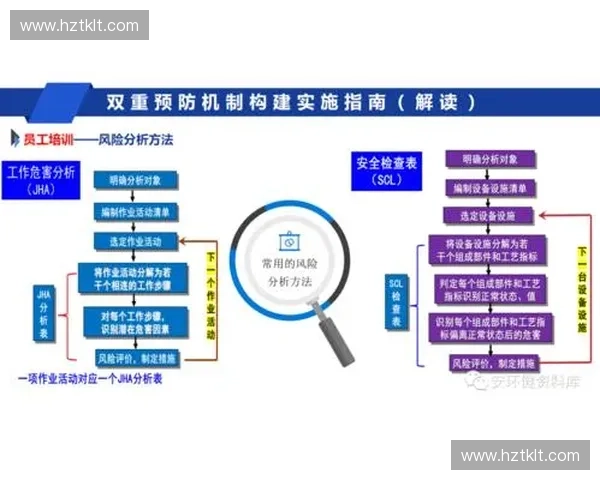
本文围绕化学反应机制展开系统性论述,从反应的关键步骤、动力学控制因素、能量变化路径以及过渡态与反应坐标的关系等多个维度进行深入解析。文章首先以约300字的摘要为全篇内容奠定整体框架,概述动力学与能量因素如何共同塑造反应进程。正文部分分为四个方向展开,分别探讨反应步骤的本质、反应速率的决定性因素、能量变化的结构化描述以及微观结构对反应路径的调控作用。每个方向均包含多个自然段的细致分析,旨在帮助读者从宏观规律到微观机制全方位理解化学反应。文章最后给出总结,从整体视角归纳研究反应机制的重要意义与应用前景。
1、反应关键步骤本质解析
在化学反应机制的研究中,分辨反应的关键步骤是理解整体反应行为的首要任务。任何反应都会由多个微观事件构成,而其中最慢、能垒最高的一步通常被称为速率决定步骤(RDS)。识别RDS不仅有助于明确反应的动力学控制点,也为调节反应速率和选择性提供理论基础。研究者常通过实验动力学、同位素标记、瞬态光谱等方法识别关键步骤,以期建立可靠的反应路径模型。
关键步骤往往与反应体系的电子结构变化密切相关。例如一些亲核取代反应中,形成碳正离子中间体可能是速率控制步骤,而在自由基链式反应中,链引发或链终止步骤则具有决定性影响。理解关键步骤需要综合分析反应过程中断裂和生成的化学键、轨道重叠程度以及参与分子间的相互作用机制。
此外,关键步骤的本质经常与过渡态的稳定性相关。过渡态是反应能量曲线上的最高点,其能量高度直接反映反应所需克服的能垒。通过量子化学方法获得过渡态结构和能量,可以更精确地界定关键步骤。同时,过渡态结构也能揭示该步骤中分子几何及电子密度的重新分配,为机制研究提供深层次信息。
2、控制反应动力学因素探讨
动力学控制因素决定了反应速度以及反应在特定条件下的进行方式。温度是最重要的动力学因素之一,根据阿伦尼乌斯方程,温度升高会显著降低反应的活化能,进而提升反应速率。然而,温度的变化不仅改变速率,也可能改变反应路径,使某些平时不占优势的途径成为主要路线。
浓度和压力同样直接影响反应动力学。对于均相反应,反应速率通常依赖于反应物浓度,而在气相反应或涉及自由基的反应中,压力对分子碰撞频率以及能量分布具有高度影响。研究这些变量的作用方式有助于解释复杂体系中反应速率的变化规律。
催化剂是调控动力学的重要手段。催化剂通过改变反应的能量路径、降低活化能或提供替代反应途径而加速反应。它们可能稳定中间体,也可能通过表面吸附提高反应物的有效碰撞概率。理解催化剂的动力学作用对于工业化学、材料科学和能源转化领域具有重大意义。
3、反应能量变化路径解析
化学反应中的能量变化通常用反应能量图或势能面(PES)来描述。能量图显示反应物转化为产物时能量的升降趋势,其中反应能垒和反应热是两个关键参数。能垒越高,反应越慢;反应热则反映反应整体是否吸放能。理解能量变化有助于预测反应是否自发进行以及反应可达的条件。
能量变化也与中间体的稳定性相关。反应过程若包含多个中间体,则每个中间体对应一个局域能量谷,而过渡态则是谷之间的能量峰。能量谷的深浅决定中间体能否被分离检测,而峰的高度决定步骤的速率。通过能量图对整个过程进行系统描绘,可以明确反应路径是否合理。
量子化学计算在能量变化分析中发挥重要作用。通过计算反应物、过渡态和产物的能量,研究者能够建立高精度的能量剖面,从而定量预测反应能垒和热力学参数。能量变化分析不仅适用于简单小分子反应,也在药物合成、催化反应和材料构筑中得到广泛应用。
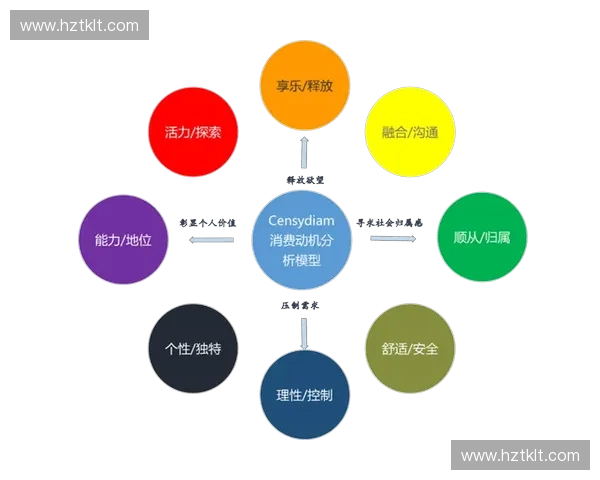
4、微观结构对反应路径调控
分子的几何结构、电子分布及取代基效应都会影响其反应路径。微观结构决定了反应物的稳定性、反应位点的活性以及过渡态的构型。例如,电子给体或吸电子基团的存在可通过诱导效应和共轭效应改变反应物的电子云密度,进而影响亲核或亲电反应的倾向性。
空间位阻在结构调控中也是不可忽视的关键因素。体积较大的取代基会降低反应物与试剂的有效接近度,从而抑制某些反应路径。位阻效应不仅影响动力学,还可能影响反应的立体选择性,使反应偏向某一特定构象或立体化学产物。
微观结构的调控还体现在溶剂效应上。溶剂的极性、粘度、氢键能力等参数会影响反应物的溶解度、离解能力和稳定性。极性溶剂常能稳定高极性过渡态,而非极性溶剂可能更有利于自由基反应。溶剂选择往往决定反应能否顺利进行,并深刻影响整体动力学和热力学特征。
总壹号大舞台28国际大舞台结:
本文从反应关键步骤、动力学控制因素、能量变化路径以及微观结构调控四个维度系统分析了化学反应机制。通过多角度的综合阐述,可以看出现代反应机制研究依赖实验与理论方法的协同,以逐步揭示反应在微观尺度上的实质。理解这些机制不仅具有科学价值,也为实际化学合成、催化优化和材料设计提供重要指导。
整体来看,化学反应机制的深入研究为探索反应可控性、提高反应效率和选择性提供了坚实理论基础。随着计算化学和先进表征技术的发展,人们将在更深层次上认识分子间的相互作用与能量演化规律,为未来化学科学的发展打开更广阔的空间。